ホーム > 「処方チェック(プレミア)」閲覧室 > オパルモンとその後発品は一包化可否の違いがあって別物と考えろ
処方チェック事例 プレミア版サンプル
オパルモンとその後発品は一包化可否の違いがあって別物と考えろ
UPDATE:2007.11.14
1. どのような医療機関ですか
開発薬局
1-3. 処方チェックをした薬剤師の経験年数
5 年
2-1. 処方箋の種類
印字出力
2-2. 患者の年齢、性別
70 歳代、女性
2-3. 処方の内容
<処方1> 病院、内科
2007 年 5 月 入院前処方
(*投稿に忠実に記載。)
<処方2> 病院、内科
2007 年 7 月 退院後処方
2007 年 5 月 入院前処方
| ダントリウムカプセル (25 mg) | 3 Cp | 1 日 3 回 | 毎食後 | 30 日分 |
| オパルモン錠 (5μg) | 6 錠 | 1 日 3 回 | 毎食後 | 30 日分 |
| モービック錠 (10 mg) | 1 錠 | 1 日 1 回 | 朝食前 | 30 日分 |
| 以上、一包化 | ||||
<処方2> 病院、内科
2007 年 7 月 退院後処方
| ダントリウムカプセル (25 mg) | 3 Cp | 1 日 3 回 | 毎食後 | 30 日分 |
| オパプロスモン錠 (5μg) | 6 錠 | 1 日 3 回 | 毎食後 | 30 日分 |
| モービック錠 (10 mg) | 1 錠 | 1 日 1 回 | 朝食前 | 30 日分 |
| 以上、一包化 | ||||
2-4. この処方で起こった (または、想定された) 問題点は何ですか?
- 当該患者の<処方 1> を以前より当薬局で一包化していたが、患者が入院中に<処方 1>の中のオパルモン錠<リマプロストアルファデクス>(小野薬品工業)から院内採用品である後発品のオパプロスモン(一包化は推奨されない製剤)(日医工)に変更されており、退院後もオパプロスモンのまま処方された。
2-5. この処方の問題点の原因は何ですか?
- オパルモンおよびプロレナール(これもリマプロストアルファデクスである、大日本住友製薬)は吸湿性があり、以前は一包化できなかったが、平成 18 年 6 月に添加物が変更されてからは旧製剤に比べ安定性が向上し、一包化もできるようになったという経緯がある*。したがって、後発品では製造方法の一部変更が反映されていない可能性があり、オパルモン(およびプロレナール)の旧製剤と同じように安定性は悪いのではないかと予測され、一包化できないのではないかと考えた。
*しかし、現在のオパルモンの医療用添付文書の取扱い上の注意欄には「本剤は吸湿性を有するので,内袋開封後は PTP 包装のまま保存し,服用時に PTP から取り出すこと。(本剤は乾燥剤を入れたアルミ箔の内袋及び防湿性の PTP を使用することにより品質保持をはかっている。)」となっている。メーカーの見解によると、25 ℃、75% RH においては(開放状態)、6 週間を過ぎると含量に減弱が見られており、患者が自宅でどのような保管の仕方をしているか予測がつかないため(75% RH に近い状態で保存している可能性もある)この注意喚起は添付文書からはずしていないということである。
2-6. 問題点に対してどのように対応しましたか?
- そこで、オパプロスモンを一包化できるのか否かを確認するため、オパプロスモンの無包装状態における安定性をメーカーに確認したところ、含量の低下が著しいことがわかった。(含量低下に関しては<その他特記すべきこと>参照)
- さらに、患者にオパプロスモンを一包化すると含量低下を生じるため一包化できないことを説明し、オパプロスモン(アルミ包装に入った PTP シート)にするか、または患者負担額が増加するが先発品のオパルモンに戻して一包化するかを相談したところ、オパルモンに戻しての一包化を希望した。
- そのため、医師に疑義照会して一包化したときの製剤の安定性の違いを伝え、オパプロスモンをオパルモンに戻してもらい、一包化することで了解を得た。院内薬剤部に確認したところ、オパルモンは在庫していないため、入院患者にはオパプロスモンで一包化しているが、入院処方のため処方日数が 1 週間から 2 週間と短く、含量低下については、あまり気にしていないとの事であった。よって、薬剤師も医師もオパルモンをオパプロスモンに変更することで、一包化時の安定性が大きく変わることは認識していなかったと思われる。
2-7. 本例から学んだことは何ですか?
- 後発品における製剤上の安定性は先発品と同じとは限らないため、特に脱ヒートを要する調剤を行う時には安定性など改めて調べる必要がある。本事例の様に、先発品において新たに製造方法の一部変更を申請し、承認されている場合は、先発品と後発品の安定性を含む品質は同等ではないことを認識すべきである。
- 短期であればさほど安定性は問題にならないかもしれないが、長期になると変質するものもあるので、退院後の処方に関しては注意が必要である。
2-8. その他特記すべきこと
ここからは、プレミア会員のみのページです。
【参考文献】
1. 関屋昇 他、薬剤学: 生命とくすり、66(2):160-166,2006.
2. 関屋昇 他、医療薬学、32(6):482-488,2006.
3. 緒方賢次 他、日本病院薬剤師会誌、39:719-722,2003.
- オパルモン錠 5μg/プロレナール錠 5μg改良に関して オパルモン錠 5μg/プロレナール錠 5μg改良に関して、1) 吸湿性などの安定性および 2)自動錠剤分包機における摩損試験の結果の概要を示す。
- 吸湿性などの安定性に関して 最新(2007 年 5 月改訂)のオパルモン錠(プロレナール錠)インタビューフォームには以下の記載がある
- 自動錠剤分包機内の摩損性試験における割れ、欠けに関して 一包化において自動錠剤分包機は汎用されているが、自動錠剤分包機では錠剤の落下を伴うことから自動錠剤分包機内の摩損性試験が行われている。摩損性試験に用いた改良製剤および比較として用いた錠剤 A(以前の報告[文献 3)]で割れ欠けが比較的起こりやすいと評価された錠剤)および錠剤 B(以前の報告で報告[文献 3)]で割れ欠けが比較的起こりにくいと評価された錠剤)の物性を表 9 に示す。さらに、自動錠剤分包機内の位置をかえた落下試験を行った結果、錠剤 B においても最上段からの落下時に 0.5-2 mm の欠けが 10-13% 認められたが、改良製剤は自動錠剤分包機内の落下距離にかかわらず自動分包時の割れ欠けが全く認められなかった(表 10)。
「また、本剤は防湿性を高めた特殊な PTP 包装を使用することにより十分な安定性が保持されているが、PTP 包装から取り出した際の安定性を向上させることを目的として製品改良を行い、添加物を変更することで従来製剤より湿度に対しての安定性を向上させた製剤の開発に成功し、2006 年 5 月 8 日製造方法の一部変更が承認された。」 この記載の内容の詳細を以下に示す[文献 1-2)]。
リマプロストアルファデクス(オパルモン錠およびプロレナール錠など)は、プロスタグランジン E1(PGE1)誘導体であるリマプロストに安定性を改善する目的でα -シクロデキストリンを添加したものである。リマプロストの主な分解物は 17 S,20-dimethyl-trans-Δ2 -PGA1(図 1 a)であり、湿度などの影響を受け、主薬の含量が減少しこの分解物が増加してくる。
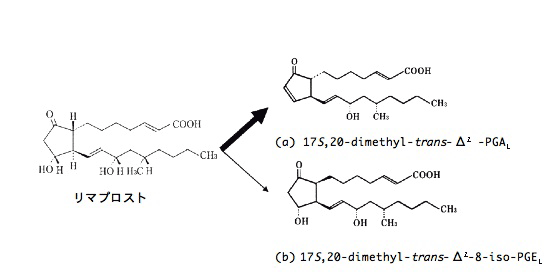
|
(文献 1) より引用改変) |
α -シクロデキストリンの添加によりリマプロストの水溶性が向上し均一分散が可能となり、生成したリマプロストアルファデクスと乳糖を凍結乾燥したものが改良以前の製剤である。この製剤は PTP 包装状態では安定であったが、PTP から取り出した状態ではとくに加湿下での安定性に欠け一包化不可であった。しかし、患者の利便性から一包化に絶えうるように、PTP から取り出し後の加湿下での安定性改善の開発が試みられ、各種賦形剤(特に糖類)の製剤に対する安定性の検討が行われた。その結果、主薬のリマプロストアルファデクスを乳糖の代わりにデキストランやデキストリンと凍結乾燥し、リマプロスト分解物生成割合を検討した結果、リマプロストアルファデクスをデキストラン 40やデキストリンと凍結乾燥することで加湿下における安定性が高まり、分解物の生成が減少した(図 2)。
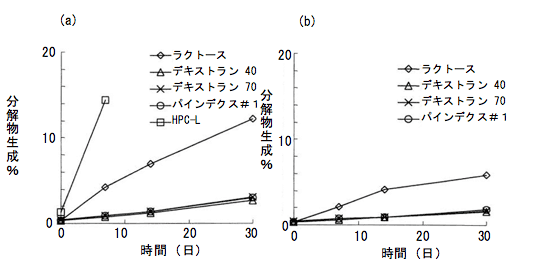
|
(開栓バイアル中の分解物の生成率、a.25 ℃、75% RH、b.25 ℃、60% RH) パインデクス#1:デキストリン(ぶどう糖当量 8)、 HPC-L:ヒドロキシプロピルセルロース |
(文献 1) より引用改変) |
さらに、デキストリン(パインデクス#1)を添加剤として加えることにより加湿下における安定性がさらに高まった(図 3)。
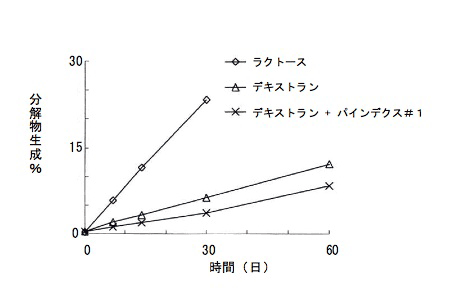
|
デキストリンを粉末添加した製剤のリマプロストの安定性に対する影響 (開栓バイアル中の分解物の生成率を測定、25 ℃、75% RH) |
(文献 1)より引用改変) |
この結果、改良されたオパルモン錠及びプロレナール錠(以下、改良製剤と表す)においては、凍結乾燥時の添加物が乳糖からデキストランに変更になり、さらに デキストリン(パインデクス#1)を添加剤として加えた組成(表 1)に決定された。
| 凍結乾燥体 | |
| デキストリン | |
| (パインデクス#1) | |
| ラクトース | |
| 軽質無水ケイ酸 | |
| ステアリン酸 | |
| トウモロコシデンプン | |
| 合計 | |
(文献 2) より引用改変) |
オパルモン錠(及びプロレナール錠)改良製剤の安定性の経時変化を表 2 に示す。さらに、リマプロストアルファデクス後発品の安定性の経時変化を表 3から表 7 に示す。表 3 〜表 7 の結果から明らかなように、現在販売されているオパルモン錠(及びプロレナール錠)改良製剤の PTP から取り出し後の安定性は顕著に向上し、分包紙の種類に関わりなく一包化に耐えうることが判明した。旧製剤である後発品の安定性は悪いことが示されている(表 3- 表 7)。表 3 から表 7 に示された、25℃ 75% RH での乾燥剤のない開放状態(無包装状態)における主薬の残存率から評価した比較表を 表 8 に示した。先発品以外は 1- 2週間でも主薬の含量が顕著に減少し、一包化は推奨されないと考えられた。
| 保存期間(週) | ||||||
| 商品名 | ||||||
| 先発品 | ||||||
| リマルモン錠 | ||||||
| オパプロスモン錠 | ||||||
| オプチラン錠 | ||||||
| ゼフロプト錠 | ||||||
| リマプロストアルファデクス錠 | ||||||
ns: データが示されていないことを示す。リマルモンは 湿度不明 |
| 改良製剤 | ||||
| 錠剤 A | ||||
| 錠剤 B | ||||
(文献 2) より引用改変) |
| 改良製剤 (イニシャル) |
||||
| 改良製剤 (25℃、75% RH-2 週) |
||||
| 錠剤 A | ||||
| 錠剤 B | ||||
(文献 2)より引用改変) |
したがって、これらの結果から改良製剤は自動錠剤分包機による一包化が可能になった。
- また、以上のように錠剤の安定性が良くなったため、先発品の改良製剤ではPTP シートのプラスチックフィルムの材質を変更することにより、従来に比べ取出しやすく改良されている。しかし、後発品に関しては、オパルモン錠の旧製品と同等、またはそれ以上に PTP シートからの取出しが困難であることが多いため、先発品から後発品に変更された場合には PTP シートが先発品より硬くて取出しにくいかもしれないことは伝える必要がある。
【参考文献】
1. 関屋昇 他、薬剤学: 生命とくすり、66(2):160-166,2006.
2. 関屋昇 他、医療薬学、32(6):482-488,2006.
3. 緒方賢次 他、日本病院薬剤師会誌、39:719-722,2003.
注 意
|
||||